从医药研发新政视角看医药产业趋势
来源:解骄阳 浏览人数:16374 时间:2017/09/18
随着我国经济不断发展、社会老龄化程度变高、疾病的慢性化特征越来越明显,人民群众对医疗健康的关注不断增强,中国医药行业的需求持续增长。人的一生避免不了看病吃药,我们每个人都受益医药产业的发展。从全球的发展趋势可以看到,绝大多数国家的医药卫生费用支出占GDP的比例都是不断提高的。医药市场的需求不仅随着各国经济发展而表现出持续繁荣,而且将超越经济发展速度并呈现出开放式增长的特点。
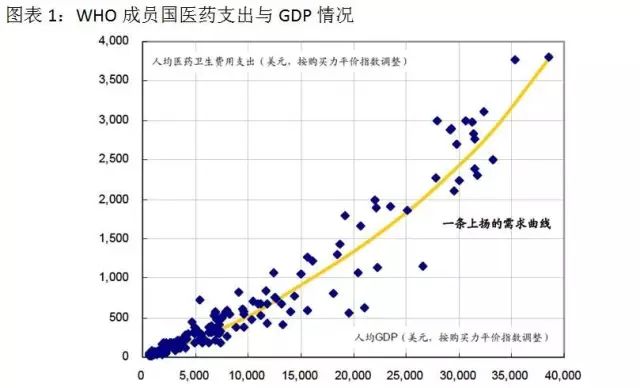
在长期看好医药产业发展的同时,我们也应该注意医药行业的特殊性。医药企业的下游主要是处于强势地位的医院等医疗机构,医院和医生很大程度上决定着患者最终医药消费。药品市场本身是非常市场化的,但医药企业所面对的是非市场化的实体——强大的产业监管系统和支付方,政策对产业影响就变得至关重要。同时研发又是医药企业长期持续发展的核心竞争力,那么从与医药研发相关的新政策这个视角切入能较好的前瞻未来产业趋势。
自2015年7月22日CFDA发布的“对1622个已申报生产或进口的待审药品注册申请开展药物临床试验数据核查”文件至今,国务院、CFDA、CDE发布了一系列重磅政策,从药品研发端鼓励我国医药企业进行创新与国际接轨,这必将给产业带来深远影响和很好的投资机会。这些政策主要包括临床数据核查、集中审评、优先审评审批、仿制药一致性评价、化学药品注册分类改革和上市许可持有人试点等。
临床试验数据自查核查是新政开端,目前已经常态化。临床数据核查按照“最严谨标准、最严格监管、最严厉处罚、最严肃问责”的要求,建立长效工作机制,确保药物临床试验数据真实可靠。数据核查开展的初衷是在审药品大量积压,阻碍了药品审批进度。此外,国家开展临床数据核查,可以获得更有效真实的临床数据,有利于患者和整个医药产业的长远发展。从目前的效果来看,临床数据核查带来大规模的撤回缓解了积压,将压缩仿制药的低水平仿制,能使审评重点转移到创新上,优化资源配置。


2016年2月26日,CFDA发布《关于解决药品注册申请积压实行优先审评审批的意见》,把重大疾病用药、创新药、优质仿制药、市场短缺药物纳入优先审评审批的范畴。在药品审评审批改革前,有近一半的时间是在CDE排队等待。
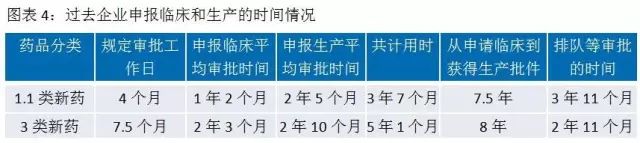
开展优先审评审批以后,纳入优先审评审批序列的药品,CDE每隔一个月会发布一批品种名单,列入优先审评的申请不再排队直接启动审评。其中对于新药的临床试验申请和生产注册申请的各个环节所需时间进行了详细规定,新药的审评审批时间得以大幅压缩。

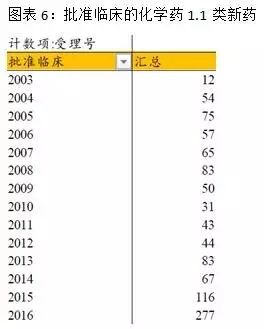
由于创新药的临床普遍比仿制药更规范和受益于优先审评审批政策,近两年批准临床的批件创历史新高。1.1类新药审批大量增加,新药放量趋势开始出现。未来会有更多的创新药和优质仿制药受益于优先审评审批,促进我国医药企业的创新升级。
国内已经有部分药企的产品通过FDA、欧盟的质量认证,近年来国内的仿制药水平受到国际上的一定认可。但是总体来说,国内的化药仿制药与原研产品在产品有效性、安全性上还有一定差距。从深化医改和医保控费的趋势下,进口替代势在必行,而一致性评价又是实现进口替代的药品质量保证。近期CFDA关于一致性评价政策的密集出台,最新的是2017年9月4日CDE发布《关于公开征求<中国上市药品目录集>框架意见的通知》,作为落实一致性评价工作的重要举措,这一中国版“OrangeBook”的制定进入起步阶段。
一致性评价对患者而言能保证用药安全,降低医疗费用;对制药企业而言,能提高用药质量,减少无序竞争;对医药行业而言,能提高整体水平,具有国际竞争力。此外,一致性评价在支付端能享有招标单独分组、按品种设定医保支付标准、优先选用通过品种等政策扶持。

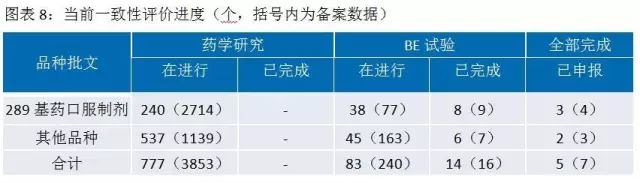
一致性评价研究耗时时间长、投入多、难度大。对于企业来说,难度主要体现在:参比制剂的确定与获取、处方工艺的研究、生物等效试验的不确定性。一个品种完成一致性评价,费用约500-800万元,耗时32-36个月。其中药学研究和二次开发花费约占一半,生物等效性试验花费约占一半。资金充裕、研发实力雄厚的大型药企会有选择的进行一致性评价研究,中小型制药企业将主要精力用于市场领先的、收入占比大的品种优先一致性评价工作,竞争力弱的相关品种直接放弃。目前一致性评价进度低于预期,但从长期来看,必将促进行业的健康发展。
此外,国务院、CFDA等还出台了许多配套政策来提高我国药品质量,促进医药行业研发创新。例如MAH(药品上市许可持有人制度)表明药品所有权属于研发公司或者个人,国家通过这个制度,鼓励创新,激励研发人员,有利于创新产品开发;对化药注册分类进行改革,定义更严格,更强调临床价值,鼓励真正的创新等。
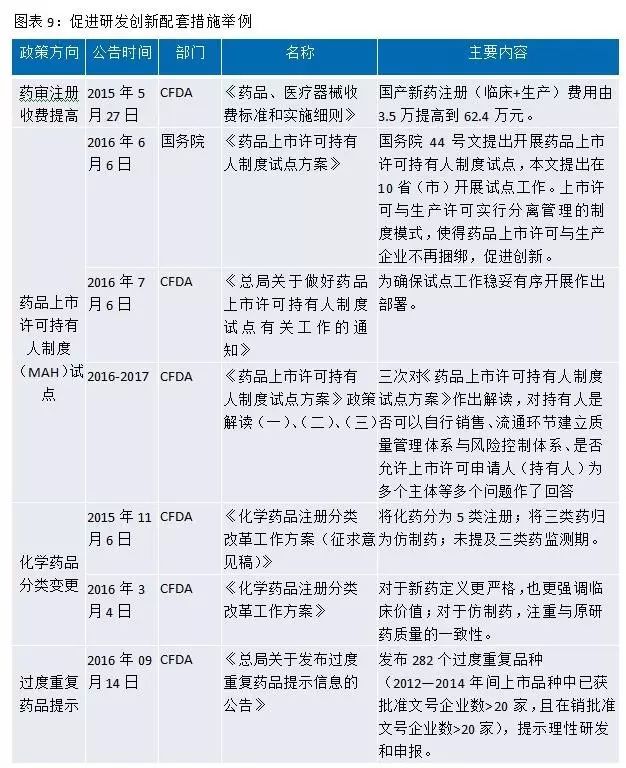
从政策的不断出台和落地来看,国家对医药研发端的创新升级可谓非常重视,速度和力度超越市场预期。新的政策给医药行业即带来挑战又带来机会,减少了注册积压,加快了审评,加快了与国际接轨,鼓励优胜劣汰,鼓励创新。当今中国医药行业正处于大的变革,研发越来越成为医药企业的核心。从世界制药发展史来看,世界级大型制药企业基本上都是研发型药企,多来自药品监管相对宽松的国家,比较从容的市场环境使制药企业能够以研发为根本追求企业的长期可持续发展。1891年美国默克成立,从默默无名的小公司开始一步步成为世界制药巨头,其发展历程值得我们去思考和学习。《制药世家默克》一书中也曾写到“制药业是那么的反复无常。一切取决于下一步的试验结果,或者是食品和药品管理局的一道命令,或者是默克新的降脂药或宫颈癌疫苗。但公司坚信,公司在2003年的利润增长会重新达到两位数。而最关键的是,默克实验室是否聚集了具有研发能力的精英,以及公司是否有东山再起的激情,不管怎样,研发和人还是制药企业的根本所在。”医药企业虽然永远受到行业政策和监管的影响,但那些立志要满足人类对健康和生命无止境追求的优秀医药企业们,必将通过不断研发创新来发展壮大并改变世界。纵观海外发达市场走过的道路,有理由相信我们正走在一条正确的道路上,我国优秀医药企业将抓住产业的变革,立足研发,走向世界,改变人类。

 粤公网安备 44030402005514号
粤公网安备 44030402005514号