带你看生物医药系列——抗体(三)
来源:解骄阳 浏览人数:11029 时间:2018/04/13
继上文对基因工程抗体相关情况进行阐述后,本文接着对抗体药物的大规模制备与分离纯化以及抗体的作用机制进行论述。
一
抗体的大规模制备与分离纯化
抗体大规模制备和纯化是抗体药物生产的关键技术,是抗体药物产业化转化的重要环节,目前国际上抗体生产在中试规模产量达到5g/L以上,商业化生产反应器规模达到20000L,单批次纯化抗体产量超过20kg,远高于国内水平。抗体生产工艺技术在过去三十多年里得到了迅猛的发展(20世纪80年代初的单抗药物刚起步时,每升抗体产量只有10mg),主要体现在3个方面:1)抗体表达水平大大提高,生产成本大幅降低;2)生产工艺安全性和稳定性大幅提高;3)工艺放大和大规模哺乳动物细胞培养经验日渐丰富。
抗体的成功大规模生产始于高水平的工艺开发,好的工艺开发需同时具备高表达(决定了工艺的经济性)、高稳定性(来源于对细胞株和工艺的深刻理解)和可放大性3个优点。同时工艺放大对抗体药物大规模的制备也很重要,成功的工艺放大是对产品质量(首要考虑)、产率和细胞活率的影响降到最低。
大规模哺乳动物细胞培养是重组蛋白和抗体药物生产的主要平台技术。悬浮细胞培养是上市抗体药物生产工艺的共同选择。悬浮细胞培养操作简单,手工操作少,易放大,还可借鉴传统发酵工艺积累的大量经验。相比细菌、酵母等表达系统,哺乳动物细胞是一个低效率的蛋白表达系统,要提高抗体生成效率主要可通过两方面实现:提高生产工艺的细胞密度和增加单个细胞的表达效率。
培养基是细胞培养和抗体生产的核心,提供了细胞生长的环境。细胞最主要的能量来源是葡萄糖和谷氨酰胺,氨基酸主要用于合成蛋白质和核酸。培养基中一般包括所有20种氨基酸,一方面提高工艺的稳定性,另一方面可减轻细胞的代谢压力。种子扩增,起于细胞复苏,止于生产反应器的接种。种子扩增的目的是通过一系列不同体积和不同类型的细胞培养装置,不断加大细胞培养体积,为抗体生产获得足够的细胞。单抗生产工艺的开发主要集中在4方面——宿主细胞、表达载体、反应器操作和培养工艺,决定了最终工艺及产品的效率和质量。
大规模抗体生成主要是利用流加工艺和灌注工艺。流加工艺较灌注工艺有3个优点——可靠性高、易放大和生产成本低。流加工艺操作简单,应用灵活,易于放大,已成为国际抗体商业化生产的主要平台技术,多家制药企业已成功实现10000L到25000L的大规模抗体生产。流加工艺开发和优化的重点就是加料的平衡和代谢副产物的抑制。灌注工艺较流加工艺也有3个主要优点——细胞生长环境更佳、适合生产已降解的产品和细胞密度更高。灌注工艺的重点是细胞分离装置和培养基的优化。分离装置可将大部分细胞截流在反应器中,是实现灌注换液和提高细胞密度的关键。灌注工艺因细胞分离装置的限制,主要用于2000L及以下规模。
细胞反应器自重组蛋白药物刚起步就涌现出了一批,但随着实践的深入,最简单的罐式搅拌反应器成为大规模细胞培养采用的主流反应器类型。罐式搅拌反应器具有1)结构简单,操作方便,清洗容易;2)细胞生长环境均一性好;3)细胞保持悬浮;4)易放大;5)传氧方式简单;6)大量发酵罐操作经验可以借鉴等优点。罐式反应器应用的最大挑战来自搅拌和鼓泡带来的高剪切力,可通过搅拌速度、鼓泡方式、气泡大小的控制,以及添加细胞保护剂等来解决。
细胞培养的工艺放大是抗体大规模生产的一个关键技术,是成功进行中试生产及商业化生产的必要条件。目前还没有成熟的指导原则,更多的是依靠经验和逐级放大的摸索。细胞培养工艺放大难度的根本原因在于哺乳动物细胞对剪切力的高敏感性。在工艺放大中,工艺参数(包括与放大无关的参数)影响较小,操作参数(与放大直接相关的参数,包括搅拌速率、鼓泡速度、碱液添加速度等)是工艺放大的重点。反应器放大后搅拌速率的确定是工艺放大最重要的一个环节。转速越高,剪切力越大。反应器在放大后应尽量控制剪切力,避免高剪切力带来的细胞和抗体产品质量变化。但为避免均一性降低带来的负面影响,在细胞耐受的情况下,大型反应器的搅拌强度也应尽量提高。
抗体分离纯化的主要目的是将抗体与工艺相关杂质和产品相关杂质分离,最终获得高纯度、低潜在危害的抗体药物。纯化过程中需要去除的工艺相关杂质包括细胞、细胞碎片、宿主细胞蛋白、宿主细胞核酸及培养基与加料液成分,需去除的产品相关杂质主要包括抗体片段和聚集体。纯化过程还需具备足够的病毒灭活去除能力,以去除宿主细胞自身表达的内源病毒样颗粒和未及时发现的外源病毒。抗体分子由于结构和物理化学性质上的相似,其分离工艺大致相同,多为利用蛋白A来捕获抗体,并利用了至少1个离子交换层析作为精纯步骤。一个典型的抗体纯化工艺为:离心、过滤——蛋白A层析——低PH孵育——阴离子层析——阳离子层析——病毒过滤——UF/DF。随着技术的进步,大规模生产抗体瓶颈从抗体表达转移到了抗体纯化。
纯化的第一步是将培养液上清与细胞及细胞碎片分离开来,大规模抗体生产主要采用连续分离的方法。蛋白A是一个金黄色葡萄球菌胞壁蛋白,对抗体纯化有很好的通用性,能去除培养上清中大部分杂质。蛋白A亲和层析工艺开发和优化的重点是抗体载量、停留时间(流速)、淋洗和洗脱条件。抗体捕获后,还需进一步精纯,一般采用两步层析以保持足够的纯化冗余。现在越来越多的公司也开始采用一步精纯来提高收率和纯化速度,降低成本。纯化的另一个重要目的是有效去除灭活收料液中的内源逆转录病毒样颗粒,以及未检测到的外源病毒。病毒灭活步骤主要包括低PH孵育和病毒过滤。
在可预见的将来,抗体生成还将保持现有的工艺路线,但工艺的效率、通量会进一步增加,成本会进一步降低。再过几年,我国包括抗体生产工艺开发和工艺放大在内的全套关键技术会逐步提高到国际先进水平。
二
单抗的作用机制简介
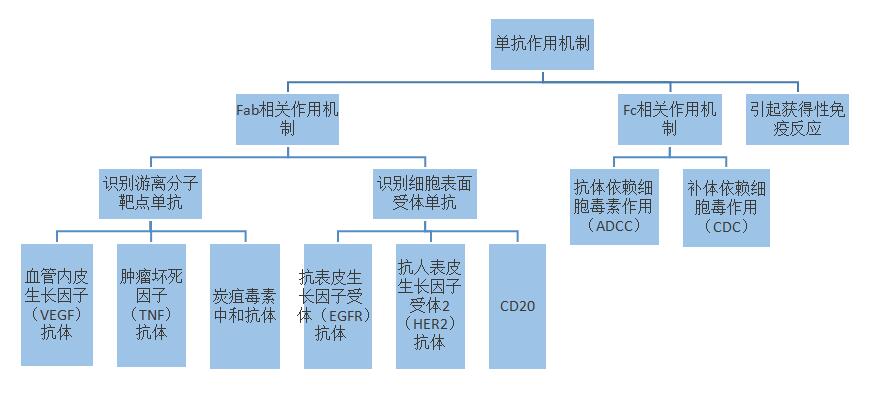
任何化合物分子的功能都是由其结构决定的,单抗也是这样。单抗由抗原结合部位(Fab)和可结晶部位(Fc)构成一个Y形结构。其中,Fab识别结合抗原靶标,决定单抗的特异性和亲和力;Fc结合表达于免疫效应细胞表面的Fc受体,以及血液中的补体和清道夫受体(FcRn),决定了单抗的免疫效应以及在机体内的半衰期。
抗体Fab相关作用机制由于抗原不同的生理学机制,可以分为识别游离分子靶点的单抗和识别细胞表面受体的单抗。1)识别游离分子靶点的单抗。游离存在于血液循环中的细胞因子、生长因子、生物毒素以及人侵的病毒等,都可以作为单抗的作用靶点。中和抗体的作用机制是通过结合抗原进行中和,使抗原丧失结合受体的能力,进而丧失生物学功能。2)识别细胞表面受体的单抗。靶点抗原表达在特定细胞表面,具有特定功能,例如细胞激活、生长或迁移。抗体可通过结合、拮抗和激活的方式与靶受体相互作用。抗体的Fc部位决定了抗体的效应功能,包括抗体依赖细胞毒作用(ADCC)和补体依赖细胞毒作用(CDC)。此外,单抗还具有类似疫苗的功能,能激发获得性免疫反应,使机体获得针对肿瘤抗原的免疫性。对抗体机制的了解,有助于投资者对抗体治疗方案优劣和具体抗体前景的分析。不同抗体的作用过程就好比一场“战争”,期间的排兵布阵、敌我态势的变化非常有趣,有时间可以私聊。由于篇幅所限,在此就不再一一展开论述具体的作用机制是如何的了。
图表一:单抗的作用机制
至此,抗体药物基本技术就已基本介绍完毕,接下来会谈谈抗体药物应用技术等方面的内容,敬请期待。
免责声明
本资料仅供本公司的合格投资者参考阅读,不因接收人收到本资料而视其为本公司的当然客户。本资料基于本公司认为可靠的且目前已公开的信息撰写,在任何情况下,本资料中的信息或所表述的意见不构成广告、要约、要约邀请,也不构成对任何人的投资建议。本资料版权均归本公司所有。未经本公司事先书面授权,任何机构或个人不得以任何形式引用或转载本资料的全部或部分内容。

 粤公网安备 44030402005514号
粤公网安备 44030402005514号